Anévrysmes intra-crâniens
Les anévrysmes intra-crâniens sont définis comme une perte de parallélisme des parois des artères intra-crâniennes. Ils peuvent présenter plusieurs formes :
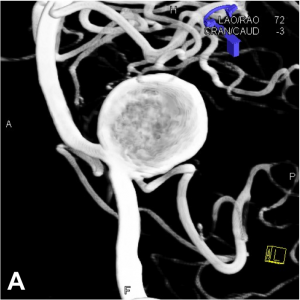
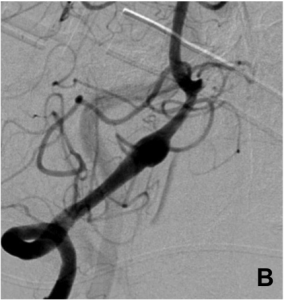
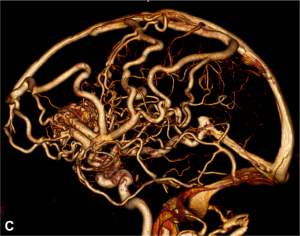
– sacculaire (forme de sac), la plus fréquente (A)
– fusiforme (dont le plus grand axe est parallèle à celui de l’artère porteuse) (B)
Les anévrysmes sont plus fréquents au niveau des bifurcations artérielles cérébrales. On distingue le sac anévrysmal (véritable « poche » greffée sur l’artère porteuse), du collet qui correspond à l’implantation de l’anévrysme sur l’artère porteuse.
Les anévrysmes intra-crâniens sont relativement fréquents dans la population générale (de 1 à 3%). Les formes familiales sont assez rares et sont observées dans moins de 10% des cas.
La plupart des anévrysmes intra-crâniens sont asymptomatiques. Ils peuvent, lorsqu’ils sont volumineux, être révélés par des céphalées ou des déficits neurologiques secondaires à la compression de nerfs crâniens.
La complication la plus grâve et la plus redoutée des anévrysmes intra-crâniens est la rupture qui conduit à une hémorragie autour du cerveau (hémorragie méningée).
Traitement des anévrysmes intra-crâniens :
Le traitement des anévrysmes intra-crâniens vise à prévenir un saignement (ou un resaignement). Il existe 2 modalités thérapeutiques :
– le traitement chirurgical par clipping (qui nécessite la réalisation d’un volet crânien)
– le traitement endovasculaire, qui se réalise par les voies naturelles (par voie artérielle)
Le traitement endovasculaire (embolisation) est une technique récente (début des années 90). Son principe consiste à occlure l’anévrysme de l’ « Intérieur », en le comblant avec du matériel métallique (appelé coils, constitués de platine).
Embolisation par coiling simple :
Le coiling simple est la technique classique de traitement endovasculaire. Il consiste à naviguer un microcathéter (très petit tuyau creux en plastique) dans le sac anévrysmal, sous contrôle des rayons X. Puis, par ce microcathéter, des coils (spires de métal à mémoire de forme) vont être déployés dans l’anévrysme. Plusieurs coils vont être implantés dans l’anévrysme, jusqu’à obtention d’une occlusion complète.
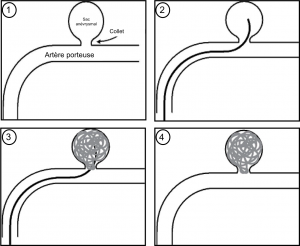
Schéma montrant les étapes du coiling. 1. Anévrysme implanté sur l’artère
porteuse ; 2. Mise en place du microcathéter dans le sac anévrysmal ;
3. Déploiement des coils ; 4. Résultat en fin de procédure : exclusion
compléte de l’anévrysme
Film montrant le déploiement d’un coil dans le sac anévrysmal
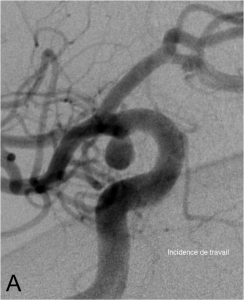
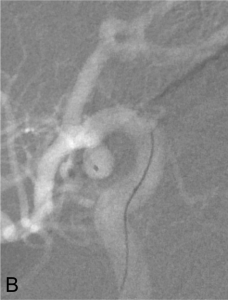
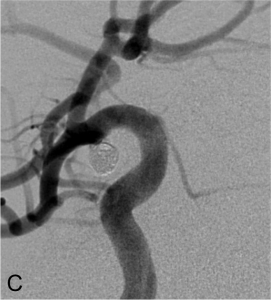
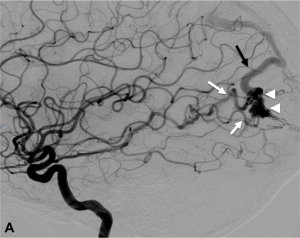
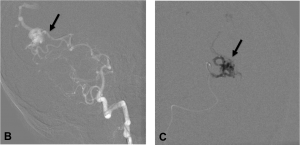
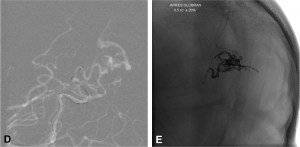
Exemple d’embolisation par coiling simple. A. Angiographie montrant l’anévrysme en position communicante
postérieure. B. Mise en place du microcathéter dans l’anévrysme. C. Résultat après le déploiement des coils ;
occlusion complète de l’anévrysme.
Embolisation par « remodeling » :
Les anévrysmes à collet large sont difficiles à traiter par coiling simple. Pour dépasser cette limite, la technique de « remodeling » consiste à utiliser, en plus du microcathéter positionné dans le sac anévrysmal, un petit ballonnet qui va être gonflé temporairement en regard du collet afin de contraindre les spires du coil et favoriser son apposition dans le sac anévrysmal.
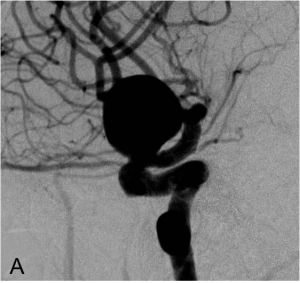
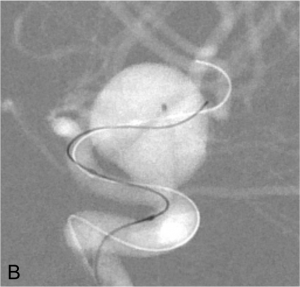
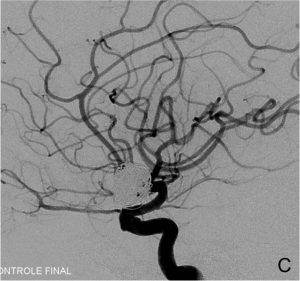
Exemple de traitement par remodeling. A. Angiographie carotidienne montrant l’anévrysme. B. Montée du
ballon de remodeling en regard du collet et du microcathéter dans le sac anévrysmal. C. Résultat en fin de
procédure après déploiement des coils sous inflations itératives du ballonnet.
Embolisation par stent + coils :
Une technique plus récente a été développée pour traiter les anévrysmes à collet large. Elle consiste à utiliser un stent (prothèse de forme cylindrique) déployé en regard du collet de l’anévrysme avant le déploiement des coils, afin d’éviter que les spires des coils ne retombent dans l’artère porteuse.
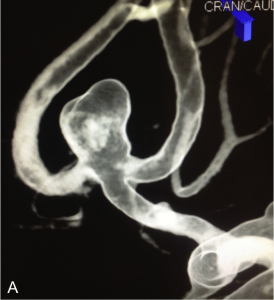
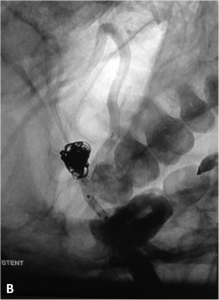
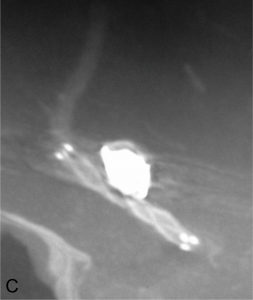
Exemple de traitement par stent + coils. A. Angiographie rotationnelle montrant un anévrysme de l’artère
communicante antérieure à collet relativement large. B. Embolisation ; un stent est déployé en regard du collet
de l’anévrysme et des coils sont déployés dans le sac. C. Résultat en fin de procédure montrant la masse de coils dans l’anévrysme et le stent.
Embolisation par stent « flow diverter » :
Les stents « flow diverters » sont une nouvelle génération de stents tressés à maillage serré, développés à la fin des années 2000. Il sont déployés dans l’artère porteuse (celle qui porte l’anévrysme) en regard de son collet. Le principe d’action de ces stents est une redirection du flux dans l’artère porteuse conduisant à l’obtention d’un flux ralenti dans le sac anévrysmal, aboutissant à une thrombose progressive. Cette technique, bien que réalisée depuis plusieurs années dans notre service, est un peu plus risquée que le coiling simple, principalement du fait de la nécessité d’un traitement concomitant par 2 anti-aggrégants plaquettaires (fluidifiant le sang) administré pour éviter une thrombose de cette prothèse, qui augmente le risque de complication hémorragique.
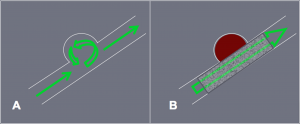
Schéma montrant le mode d’action des stents « flow diverters ».
A. Circulation dans le sac anévrysmal avant implantation du stent.
B. Redirection du flux dans l’artère porteuse entrainant une thrombose
progressive du sac anévrysmal.
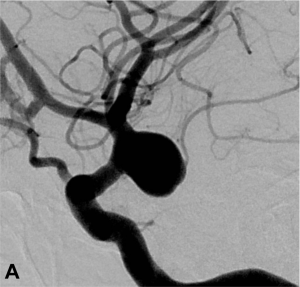
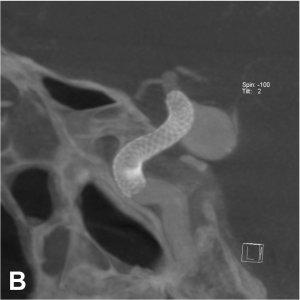
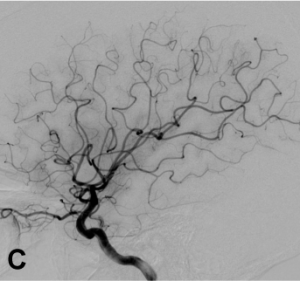
Exemple de traitement d’un anévrysme par stent « flow diverter ». A. Angiographie carotidienne de profil
mettant en évidence un anévrysme sacculaire. B. Acquisition type scanographique après positionnement
du stent dans l’artère porteuse. C. Contrôle à 1 an montrant une exclusion complète de l’anévrysme.
Nouveaux dispositifs pour le traitement des anévrysmes intra-crâniens :
De nouveaux dispositifs, dits de « diversion intra-anévrysmale » ont été développés ces 2 dernières années. Ces dispositifs ont des formes de sphère ou de cylindre (forme choisie en fonction de la morphologie de l’anévrysme). En réduisant le flux dans le sac anévrysmal, ils vont entrainer une thrombose progressive de celui-ci.
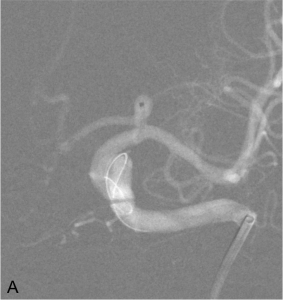
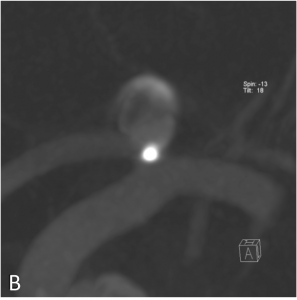
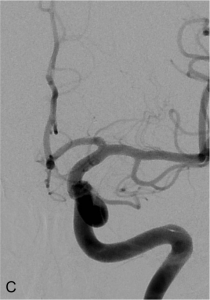
Exemple de traitement par système de diversion intra-anévrysmale (système « LUNA ») d’un anévrysme de la terminaison carotidienne gauche. A. Mise en place du microcathéter dans le sac anévrysmal. B. Acquisition type scanographique montrant le déploiement du système (forme de sphère) dans le sac anévrysmal. C. Contrôle angiogrpahique à 1 an montrant une exclusion complète de l’anévrysme.
Pour un avis sur un anévrysme intra-crânien, vous pouvez nous contacter au : 01 42 16 35 99 ou au 01 42 16 35 10
Pour tous les anévrysmes diagnostiqués en dehors de l’urgence (rupture), une angiographie cérébrale doit être réalisée de façon programmée. Avant cet examen, le neuroradiologue vous recevra en consultation pour vous expliquer le déroulement de l’examen. Par le suite, votre dossier sera discuté en staff multi-disciplinaire. L’indication thérapeutique et la modalité la plus adaptée (chirurgie ou embolisation) seront discutées. Vous serez ensuite reconvoqué en consultation pour que vous soit exposée la proposition thérapeutique, ses bénéfices, risques et modalités pratiques de réalisation.
Malformations artério-veineuses
Les malformations artério-veineuses cérébrales (MAVc) sont des malformations vasculaires agressives à haut débit présentant un shunt artério-veineux. Leur origine reste à ce jour encore mal connue ; certains auteurs évoquent une anomalie de maturation vasculaire post-veinulaire durant les premiers mois de vie aboutissant à la formation des MAVc. Cette pathologie est rare ; son incidence (nouveaux cas diagnostiqués) est estimée à environ 1-1,5/100 000 personnes/an. Elle se révèle la plupart du temps chez des sujets jeunes (20-30 ans). Le mode de révélation le plus fréquent est l’hémorragie (environ 50% des modes de présentation) qui se manifeste la plupart du temps sous la forme d’un hématome intra-cérébral parfois associé à une hémorragie sous-arachnoïdienne, et dont les conséquences en terme de séquelles neurologiques peuvent être sévères. La sévérité de l’hémorragie liée à la rupture de la MAVc peut parfois conduire au décès. Les autres modes de présentation sont les crises comitiales, les céphalées et les déficits neurologiques focaux.
Les MAVc sont caractérisées par
– des apports artériels (afférences) qui sont la plupart du temps des branches piales, cheminant à la surface du cerveau
– un réseau de vaisseaux dysplasiques, présentant des caractéristiques histologiques d’artère et de veine, appelé nidus
-’une ou plusieurs veines de drainage, le plus souvent dilatées.
Le potentiel hémorragique de ces malformations, particulièrement de celles ayant déjà présenté un épisode de saignement, rend parfois un traitement préventif nécessaire. Ce traitement vise à une éradication angiographique complète de la malformation. Trois modalités thérapeutiques interviennent dans le traitement des MAVc ; celles-ci sont complémentaires et peuvent être réalisées successivement chez le même patient selon une stratégie thérapeutique dépendant des protocoles locaux de chaque centre. Les 3 possibilités thérapeutiques pour le traitement des MAVc sont : le traitement endovasculaire, le traitement chirurgical et la radiothérapie stéréotaxique.
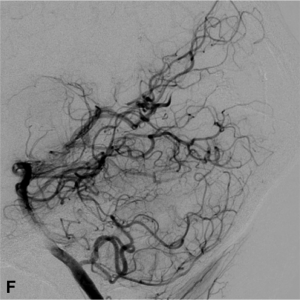
Le neuroradiologue interventionnel intervient à deux titres dans la prise en charge des MAVc. Tout d’abord il permet, par la réalisation d’une angiographie cérébrale numérisée soustraite par cathétérisme sélectif, d’obtenir un bilan angiographique complet et précis de la MAVc. Celui-ci détaillera les afférences artérielles, la forme (éparse ou compacte) et la taille du nidus, ainsi que le drainage veineux. Ce bilan permet donc de définir l’ « angio-architecture » de la MAVc (Fig. 1).
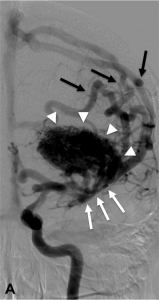
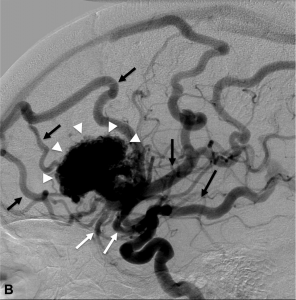
Figure 1.
Malformation artério-veineuse (MAV) frontale gauche non-rompue révélée par des céphalées Angiographie numérisée soustraite de face (A) et profil (B) montrant les afférences artérielles de la MAV (flèches blanches), le nidus (têtes de flèches) et les veines de drainage (flèches noires). C. Angiographie rotationnelle en projection latérale gauche permettant d’obtenir une image 3D en rendu volumique de la malformation.
Il permet également d’évaluer le risque hémorragique de la malformation (localisation profonde, drainage veineux profond unique, sténose sur la veine de drainage principale) et de mettre en évidence des « zones de fragilité » de la malformation (anévrysmes pédiculaires, intra-nidaux, composante sous-épendymaire du nidus). Le bilan d’imagerie doit également être complété par une IRM cérébrale qui permettra la localisation précise de la malformation (corticale, profonde, localisation par rapport aux aires cérébrales éloquentes), la recherche de stigmates hémorragiques (sur la séquence T2 écho de gradient) et les rapports avec les aires fonctionnelles comme celles du langage, par la réalisation d’une IRM fonctionnelle.
En dehors de l’urgence (MAVc rompue présentant un risque de resaignement aigu élevé), toute proposition thérapeutique pour une MAVc devra faire l’objet d’une discussion multi-disciplinaire regroupant neuroradiologues interventionnels, neurochirurgiens et radiothérapeutes.
Dans la plupart des centres, le traitement endovasculaire (embolisation) est proposé en première intention. Le principe de l’embolisation des MAVc consiste en l’injection d’un agent embolique liquide (colle biologique [n-butyl-cyanoacrylate] ou Onyx® [ethylene vinyl alcohol]) dans les vaisseaux dysplasiques du nidus afin de les occlure. Pour se faire, un microcathéter est navigué sous contrôle scopique dans une ou plusieurs afférences artérielles au plus proche du nidus (position juxta-nidale) et l’agent embolique est injecté afin d’occlure le nidus (Fig. 2).
Figure 2.
MAV occipitale gauche non-rompue révélée par des troubles visuels.
A. Angiographie numérisée soustraite de l’artère carotide interne gauche de profil. Visualisation d’une MAV occipitale gauche (têtes de flèche) alimentée par des branches corticales de l’artère cérébrale postérieure gauche (flèches blanches). Drainage veineux cortical unique superficiel (flèche noire).
Embolisation à la colle biologique (n-butyl-cyanoacrylate). B. Microcathétérisme d’un premier pédicule. Le microcathéter est navigué au plus près du nidus (flèche). C. Injection de la colle sous contrôle scopique (flèche). D. Microcathétérisme d’un second pédicule sous contrôle scopique. E. Cliché non-soustrait après injection de la colle biologique par le second pédicule. F. Angiographie numérisée soustraite de l’artère vertébrale gauche de profil en fin de procédure montrant une exclusion angiographique complète de la malformation.
L’injection ne devra pas être trop proximale sous peine d’être inutile (risque de recrutement d’artères nourricières adjacentes) voire dangereuse (occlusion d’artère(s) normale(s) vascularisant du parenchyme cérébral sain), ni trop distale (occlusion ou ralentissement de la veine de drainage principale) exposant à un risque hémorragique retardé lorsque l’occlusion du nidus est incomplète. La plupart du temps le traitement endovasculaire se fait en plusieurs sessions du fait de la longueur du geste et du risque hémorragique lié aux modifications hémodynamiques brutales de la MAVc. Le traitement endovasculaire seul permet une exclusion complète de la MAVc dans 25 à 80 % des cas, selon les caractéristiques de la MAVc et l’expérience du centre où est réalisé le geste. L’embolisation présente néanmoins des risques (séquelle neurologique définitive, voire, bien qu’exceptionnel, décès). Les données de la littérature sont assez imprécises et parfois contradictoires sur ce risque. Il est évalué à environ 8% de complications neurologiques par session d’embolisation. Lorsque l’embolisation ne peut être complète (pédicules alimentant la MAVc trop petits pour permettre un cathétérisme) le reliquat pourra être traité par résection microchirurgicale et/ou radiothérapie stéréotaxique, dont le principe consiste à focaliser un rayonnement ionisant sur le nidus en condition stéréotaxique afin d’obtenir une sclérose progressive des vaisseaux dysplasiques du nidus.
Pour un avis sur une malformation artério-veineuse, vous pouvez nous contacter au : 01 42 16 35 99 ou au 01 42 16 35 10
Pour toutes les MAV diagnostiquées en dehors de l’urgence (rupture), une angiographie cérébrale doit être réalisée de façon programmée. Avant cet examen, le neuroradiologue vous recevra en consultation pour vous expliquer le déroulement de l’examen. Par le suite, votre dossier sera discuté en staff multi-disciplinaire. L’indication thérapeutique et la modalité la plus adaptée (embolisation, chirurgie et/ou radiothérapie stéréotaxique) seront discutées. Vous serez ensuite reconvoqué en consultation pour que vous soit exposée la proposition thérapeutique, ses bénéfices, risques et modalités pratiques de réalisation.
Tassements vertébraux
Le tassement vertébral est défini comme une diminution de hauteur d’un corps vertébral. Véritable fracture du corps vertébral, il est responsable de douleurs et de limitations fonctionnelles (réduction du périmètre de marche, limitation des mouvements …).
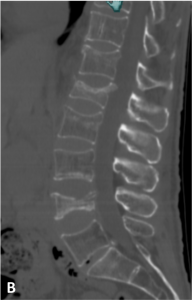
Les tassements vertébraux peuvent être d’origine traumatique (chute, accident de la voie publique), d’origine tumorale (fracture sur un os pathologique fragilisé) (A) ou liés à l’ostéoporose (B).
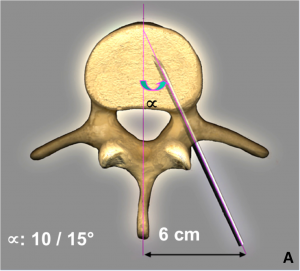
La vertébroplastie percutanée est une technique récente (développée au milieu des années 80) permettant de traiter de façon mini-invasive (sans incision chirurgicale) ces tassements. Elle consiste à injecter un polymère plastique (polyméthyl-méthacrylate) dans le corps de le vertèbre afin de la consolider.
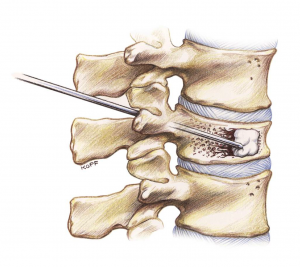
Schéma montrant le principe de la réalisation
d’une vertébroplastie percutanée
Cette procédure est réalisée la plupart du temps sous sédation consciente en décubitus ventral. Une anesthésie locale du trajet des trocarts est réalisée. Puis, les trocarts (grosses aiguilles) sont insérés, sous contrôle radiologique, dans le corps de la vertèbre. Une fois le bon positionnement dans la vertèbre obtenu, le ciment acrylique est injecté sous contrôle radiologique. Le ciment, liquide dans les premières minutes, va diffuser dans la vertèbre et solidifier en quelques minutes (< 15 min). Plusieurs vertèbres peuvent être traitées durant la même session. La durée de l’intervention n’excède généralement pas une heure.
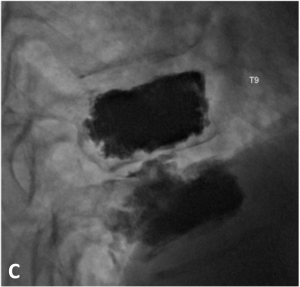
A. Schéma montrant le positionnement du trocart dans la vertèbre. B. Injection du ciment acrylique sous contrôle radiologique par le radiologue. C. Résultat en fin de procédure. Remplissage satisfaisant des corps vertébraux par le ciment.
Le levé peut se faire 6h après l’intervention. Celle-ci ne laisse pas de cicatrice. La sortie de l’hôpital s’effectue généralement le lendemain de l’intervention. Les douleurs peuvent augmenter transitoirement dans les 24-48h suivant l’intervention. Pour prévenir cette recrudescence transitoire des douleurs, des antalgiques sont prescrits durant l’hospitalisation et à la sortie de l’hôpital.
Pour un avis sur un tassement vertébral douloureux, vous pouvez nous contacter au : 01 42 16 35 97
Accidents vasculaires
Définition
Un accident vasculaire cérébral ischémique (AVC) est un déficit neurologique brutal d’origine vasculaire causé par un infarctus au niveau du cerveau. Les symptômes peuvent être très variés selon le siège et la taille de la lésion cérébrale, ce qui explique un large spectre : aucun signe remarquable, perte de la motricité, perte de la sensibilité, trouble du langage, perte de la vue, perte de connaissance, décès. Ces symptômes, s’ils apparaissent très rapidement (en quelques secondes), peuvent disparaître aussitôt ou en quelques heures (on parle alors d’accident ischémique transitoire ou AIT) ou au contraire persister plus longtemps (on parle alors d’accident ischémique constitué ou AIC). Après l’accident, une période de récupération spontanée allant de quelques semaines à quelques mois, suivie d’une période d’évolution plus lente pendant plusieurs années, est constatée, le délai et le degré de recupération clinique étant dépendant de plusieurs facteurs et variable d’un patient à l’autre. Des séquelles plus ou moins lourdes peuvent persister à long terme.
Dans les pays occidentaux (Europe, États-Unis, etc.), un individu sur 600 est atteint d’un accident vasculaire cérébral chaque année (120 000 en France). 80 % d’entre eux sont des ischémies et 20 % des hémorragies. La probabilité de faire un AVC ischémique augmente avec l’âge. L’AVC est la première cause de handicap physique de l’adulte et la troisième cause de décès dans la plupart des pays occidentaux.
Les accidents ischémiques sont dus à l’occlusion d’une artère cérébrale ou à destinée cérébrale (carotides internes ou vertébrales). Le cerveau est donc partiellement privé d’oxygène et de glucose. Cette occlusion entraîne un infarctus cérébral et donc la mort d’une partie du tissu du cerveau. Chaque minute qui passe voit la destruction de deux millions de neurones. Le mécanisme de cette occlusion est le plus souvent soit un athérome obstructif, soit un caillot (de formation locale ou par embolie le plus souvent d’origine cardiaque). Cependant d’autres causes peuvent exister : déchirure de la paroi de l’artère (dissection), compression par une tumeur.
L’infarctus cérébral d’origine ischémique peut se compliquer secondairement d’un saignement au niveau de la lésion : on parle alors de ramollissement hémorragique.
L’hypertension artérielle est le principal facteur de risque d’AVC. Chez une personne en bonne santé, la pression artérielle doit être inférieure à 140/90 mmHg.
D’autres importants facteurs de risques incluent :
- Arythmie cardiaque
- Âge (augmentation de la « rigidité » de la paroi vasculaire)
- Diabète
- Tabac
- Antécédents familiaux
Pour un accident vasculaire cérébral, six signes peuvent survenir (pas nécessairement tous) :
- Perte de la motricité et de la force d’un bras, d’une jambe, de la moitié du visage (déviation de la bouche) ou de la totalité d’un côté du corps (hémiplégie). Ce déficit peut être total ou partiel. Dans ce dernier cas, on parle d’hémiparésie
- Perte de la sensibilité d’un bras, d’une jambe, de la face ou de tout un côté du corps
- Difficulté soudaine à trouver les mots ou à les exprimer : les phrases ou les mots sont incompréhensibles ; les mots ou les syllabes sont remplacés par d’autres proches phonétiquement (aphasie sensitive dite de Wernicke) ; difficulté à trouver les mots, sans trouble de compréhension (aphasie motrice dite de Broca)
- Trouble soudain de l’équilibre et de la marche, pouvant conduire à des chutes
- Perte soudaine de la vision d’un œil (amaurose), diplopie (vision double) ou vision floue, due à des troubles de l’accommodation
Diagnostic
Le diagnostic d’AVC aigu est effectué sur la base de correlations clinique-imagerie (scanner et IRM). L’absence d’hémorragie oriente vers l’origine ischémique du déficit. Le scanner à la phase hyperaiguë est souvent négatif (des signes précoces étant parfois décélables), alors que l’IRM permet de mettre en évidence de façon précise l’étendue de la lésion ischémique ainsi que le niveau de l’occlusion artérielle et la présence éventuelle de micro-hémorragies.
Traitement
Le traitement de l’AVC ischémique aigu ainsi que son efficacité sont conditionnés par le délai de prise en charge du patient après le début des symptômes, ainsi que par l’étendue de l’ischémie. Si le patient arrive à l’hôpital avant 4h30’, l’injection intra-veineuse de fibrinolytique est possible avec un faible risque de complication hémorragique. Entre 4h30 et 6h, la thrombectomie mécanique par voie endovasculaire est en général préférée. Pour les occlusions de l’artère basilaire (artère qui alimente le tronc cérébral), événement potentiellement fatal, une démarche plus aggressive avec traitement endovasculaire d’emblée, même au délà des 6 heures, est généralement proposée, après évaluation de l’étendue de l’ischémie par imagérie.
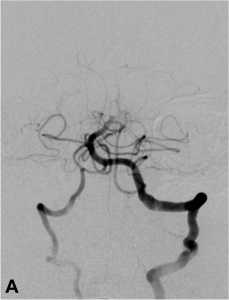
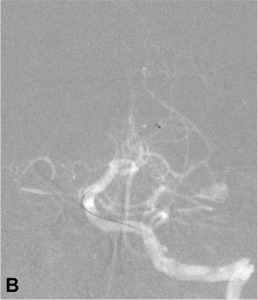
Exemple de thrombectomie mécanique sur une occlusion du tronc basilaire. A. Angiographie montrant l’occlusion
du tiers moyen du tronc basilaire ; B. Mise en place du système de retrait dans le caillot ; C. Résultat final :
recanalisation complète du tronc basilaire et de ses branches
Les traitements endovasculaires disponibles pour l’AVC ischémique consistent en l’utilisation de dispositifs de retrait du caillot, dits stentrievers, associés ou non à l’injection directe du fibrinolytique in situ. Plus récemment, des systèmes de thromboaspiration directe ont été developpés, avec des résultats encourageants.
Plusieurs études publiées en 2015 ont montré la supériorité, pour les AVC ischémiques à la phase aiguë avec occlusion vasculaire proximale, de la thrombectomie mécanique +/- associée à la thrombolyse intra-veineuse, par rapport à la thrombolyse intra-veineuse seule.
Fistules artério-veineuses durales
Définition
Les fistules artério-veineuses (FAV) se définissent comme des shunts artério-veineux anormaux au niveau de la dure-mère (enveloppe entourant le système nerveux central).
Elles se distinguent des MAV par leur topographie (durale vs piale) et par l’absence de nidus. Il s’agit en fait d’une communication directe (shunt) entre des branches artérielles méningées et une veine (généralement un sinus dural) d’origine acquise, secondaire à un épisode inflammatoire ou thrombotique qui se produit au sein d’une veine de la dure mère à un moment de la vie et qui entraine le recrutement de vaisseaux artériels (neo-angiogénèse) lesquels vont se greffer directement sur la paroi veineuse.
Le shunt artério-veineux retentit sur la circulation intracrânienne physiologique par un mécanisme de vol vasculaire ou d’engorgement veineux et peut entraîner une perturbation de l’activité cérébrale, une élévation de la pression intra-crânienne ou encore un événement hémorragique.
Le diagnostic de FAVd est évoqué sur la base d’arguments cliniques (signes et symptômes) et sur les données d’imagerie (angio-scanner ou angio-IRM). Il est ensuite confirmé par l’angiographie cérébrale numérisée.
Histoire naturelle, modes de drainage, risque de rupture
Les symptômes révélateurs sont multiples et ils dépendent de la localisation et du degré de perturbation hémodynamique :
- acouphènes pulsatiles
- troubles visuels
- exophtalmie (en cas de fistules du sinus caverneux)
- céphalées
- crises d’épilepsies
- ralentissement cognitif
- déficits neurologiques focaux
- Le principal risque lié aux FAVd est la rupture, responsable d’une hémorragie
intra-crânienne, potentiellement source de séquelles permanentes. - Ce risque est corrélé au type de drainage veineux (drainage lepto-méningé plus à risque que le drainage par sinus veineux) ainsi qu’à la localisation du point de fistule (selon la zone du cerveau atteinte par l’hémorragie). L’indication de traitement est posée en fonction des signes cliniques et de l’angio-architecture du drainage veineux.
- En cas de rupture, les FAVd se révèlent typiquement par un hématome intra-parenchymateux (hémorragie dans le tissu cérébral), un hématome sous-dural et/ou par une hémorragie méningée (autour du cerveau).
Modalité de traitement
- Selon la localisation de la FAVd et le type de drainage, deux principales modalités thérapeutiques peuvent être envisagées, le but du traitement étant l’oblitération de l’origine de la veine concernée afin d’éviter toute récidive :
– Le traitement chirurgical, qui nécessite une ouverture de la boîte crânienne
– Le traitement endovasculaire, qui se fait par les vaisseaux.
Pour les techniques endovasculaires, 2 abords peuvent s’envisager :
– le traitement par voie artérielle : il consiste en l’injection de colle ou agent embolique liquide
plus « visqueux » (Onyx®) dans les artères afférentes jusqu’à fermeture du shunt AV.
– le traitement par voie veineuse : cette voie d’abord est en général adoptée lorsque la voie
artérielle est jugée peu praticable, typiquement pour les fistules profondes du sinus
caverneux.
L’embolisation est réalisée par remplissage de la veine de drainage avec coils et/ou Onyx jusqu’à oblitération complète du shunt AV.
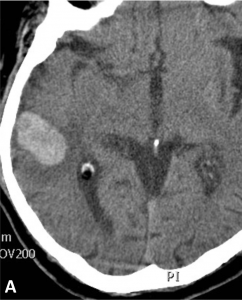
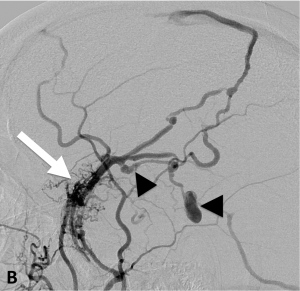
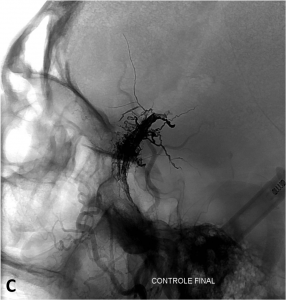
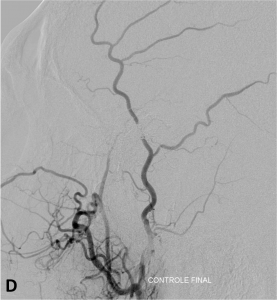
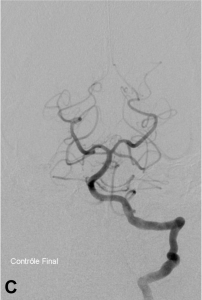
Exemple de traitement d’une fistule durale rompue. A. Scanner cérébral montrant un hématome temporal droit spontané. B. Angiographie de l’artère carotide externe montrant une fistule entre l’artère méningée moyenne et une veine corticale (flèche). Présence de plusieurs dilatations veineuses focales (têtes de flèche). C. Embolisation à l’Onyx de la fistule par voie artérielle. D. Angiographie de contrôle de l’artère carotide externe montrant une guérison complète de la fistule.
Independemment de la modalité, le traitement des FAV est effectué sous anesthésie générale.
L’angiographie cérébrale diagnostique et la consultation d’anesthésie sont préalables à la réalisation du geste thérapeutique.
Pour un avis sur une fistule artério-veineuse, vous pouvez nous contacter au : 01 42 16 35 99 ou au 01 42 16 35 95
Pour toutes les FAVd diagnostiquées en dehors de l’urgence (rupture), une angiographie cérébrale doit être réalisée. Avant cet examen, le neuroradiologue vous recevra en consultation pour vous expliquer le déroulement de l’examen. Par le suite, votre dossier sera discuté en staff multi-disciplinaire. L’indication thérapeutique et la modalité la plus adaptée (embolisation, chirurgie et/ou radiothérapie stéréotaxique) seront discutées. Vous serez ensuite reconvoqué en consultation pour que vous soit exposée la proposition thérapeutique, ses bénéfices, risques et modalités pratiques de réalisation.
Métastases osseuses/Tumeurs osseuses primitives
Métastases osseuses : Définition, épidémiologie
Les métastases osseuses (MO) sont définies comme des foyers tumoraux se développant dans les structures osseuses, en rapport avec l’implantation et la prolifération de cellules néoplasiques provenant d’une tumeur mère située à distance. La dissémination de ces cellules tumorales se fait par voie sanguine la plupart du temps, ou, plus rarement, par voie lymphatique. Les MO représentent les plus fréquentes des lésions osseuses tumorales. Elles ont un tropisme préférentiel pour le squelette axial (rachis, pelvis), pour la voûte crânienne et les fémurs (cols), mais peuvent toucher n’importe quelle pièce osseuse. Le squelette est le quatrième organe le plus affecté en fréquence par les lésions secondaires, après les ganglions lymphatiques, le poumon et le foie. Plusieurs types de cancer peuvent métastaser à l’os. Par ordre de fréquence décroissant, les tumeurs les plus ostéophiles sont : les tumeurs du sein, de la prostate, de la thyroïde, du poumon et du rein. Dans environ 20 % des cas, une diffusion métastatique osseuse est présente d’emblée au moment du diagnostic.
Par ordre de fréquence, le premier mode de révélation des MO est la douleur. Celle-ci peut être intermittente initialement, puis, en l’absence de traitement, elle peut devenir continue et insomniante et entrainer une dégradation de la qualité de vie. Les autres modes de révélation, moins fréquents, sont les fractures pathologiques (principalement le col du fémur), survenant la plupart du temps spontanément ou consécutivement à un traumatisme mineur, les compressions médullaires ou neurologiques, et l’hypercalcémie ; ces deux dernières complications constituant des urgences thérapeutiques. Les MO sont la cause la plus fréquente de douleurs chroniques chez les patients porteurs d’une néoplasie. Malheureusement, ces douleurs sont la plupart du temps insuffisamment soulagées par les traitements habituels. Jusqu’à 55 % des patients porteurs d’un cancer se plaignent de douleurs. Parmi ces malades, 46 % rapportent une douleur insuffisamment soulagée. La douleur est fréquemment décrite comme une sensation de transpercement et de brûlure, évoluant de façon fluctuante. Les morphiniques, souvent utilisés en première ligne, sont une épée à double tranchant. Les bénéfices sur le soulagement de la douleur sont contrebalancés par les effets secondaires : ralentissement psychomoteur, constipation, nausées, et phénomène de tolérance nécessitant l’augmentation des doses. Les morphiniques sont fréquemment intégrés dans une prise en charge thérapeutique multimodale incluant les biphosphonates, la chimiothérapie, l’hormonothérapie, les radio-éléments, et la radiothérapie. Tous ces traitements, seuls ou combinés, ont un succès limité, et un grand nombre de patients restent avec une douleur non-soulagée. D’autre part, ces thérapeutiques présentent comme inconvénient qu’elles peuvent masquer un risque fracturaire pour les MO intéressant des régions porteuses.
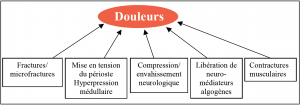
Schéma représentant les différents mécanismes impliqués
dans les douleurs secondaires aux MO
En complément des traitements par voie générale (chimio-thérapies, hormonothérapie, immunothérapie et bi-phosponates), la radiologie interventionnelle, par des interventions mini-invasives, a pris ces dernières années une place prépondérante dans le traitement local et ciblé des MO hyper-algiques.
L’arsenal thérapeutique de la radiologie interventionnelle dans cette indication comprend plusieurs techniques qui peuvent être complémentaires :
– la cimentoplastie
– la chimio-embolisation
– la radio-fréquence per-cutanée
– la cryo-ablation
Cimentoplastie :
Ce geste consiste à injecter un ciment acrylique (sorte de plastique) dans la pièce osseuse touchée par la MO via une aiguille (trocart) positionnée dans la lésion sous contrôle radiologique.
Ce geste ne nécessite pas d’ouverture chirurgicale. Son effet antalgique est observé dans plus de 90% des cas; il est la plupart du temps rapide (dans les 72h).
En plus de l’effet antalgique, la cimentoplastie a un effet de consolidation qui prévient la survenue de fracture sur l’os fragilisé par la MO.
Enfin, de par la chaleur délivrée par la polymérisation du ciment, on observe également un effet de destruction tumorale (« carcinolytique ») prévenant dans un grand nombre de cas la récidive locale.
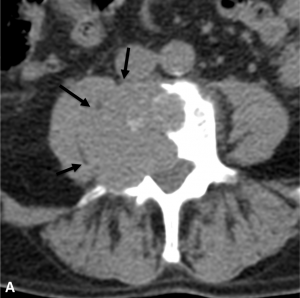
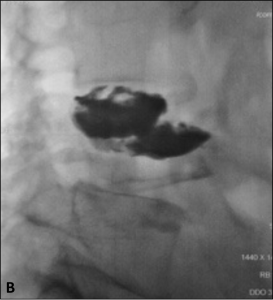
Exemple de cimentoplastie sur une lésion lytique de la vertèbre L4 hyper-algique. A. Scanner
montrant la lésion lytique (flèches). B. Résultat après cimentoplastie ; remplissage satisfaisant
de la lésion accompagné d’une nette régression des douleurs.
Chimio-embolisation :
La chimio-embolisation consiste à injecter dans les artères alimentant une lésion osseuse une ou plusieurs chimio-thérapies, dont l’efficacité sera augmentée du fait d’une concentration locale élevée. Cette intervention se fait par voie artérielle fémorale au moyen d’un cathéter qui sera positionné sous contrôle radiologique dans les artères alimentant la lésion osseuse.
Radio-fréquence per-cutanée :
La radio-fréquence per-cutanée est un traitement mini-invasif utilisant une sonde (aiguille droite), positionnée au sein de la lésion sous contrôle radiologique, qui va émettre des ondes de radiofréquence entrainant un échauffement local (entre 55 et 100°C) conduisant à la destruction tumorale thermique. Son efficacité en terme de destruction tumorale et en terme d’analgésie est très bonne.
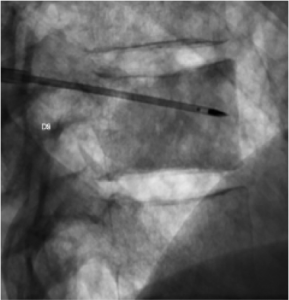
Exemple de radio-fréquence per-cutanée d’une
lésion vertébrale thoracique
Cryo-ablation :
La cryothérapie vise à détruire la tumeur par congélation des tissus. La congélation est obtenue par l’introduction d’une sonde placée sous contrôle radiologique au centre de la
tumeur. Le dispositif de cryo-ablation génère une température de – 100°C à l’extrémité de la
sonde par circulation d’argon. Si l’emploi de la cryothérapie en chirurgie est ancienne, son application aux techniques percutanées est plus récente. D’un usage relativement répandu pour le traitement des lésions tumorales hépatiques, son utilisation pour le traitement des lésions osseuses ne date que de quelques années.
Tumeurs osseuses primitives :
Les tumeurs osseuses primitives peuvent être malignes (ostéosarcome, chondrosarcome, …) ou bénignes (angiome, ostéome ostéoïde, kyste anévrysmal, …). Si les tumeurs osseuses primitives malignes relèvent le plus souvent de la chirurgie, les tumeurs osseuses primitives bénignes peuvent être traitées par technique de radiologie interventionnelle avec une bonne efficacité.
Les 2 principales lésions traitées par les techniques mini-invasives per-cutanées sont les angiomes agressifs et les ostéomes ostéoïdes.
Angiome agressif :
Les angiomes sont des lésions bénignes fréquentes au niveau du rachis. Parfois, ils peuvent atteindre l’arc postérieur de la vertèbre ou s’étendre au canal rachidien et se manifester par des douleurs ou des compressions nerveuses ; on parle alors d’angiome agressif. Le traitement de ces angiomes peut se faire par vertébroplastie simple ou par sclérose à l’alcool absolue suivie d’une vertébroplastie.
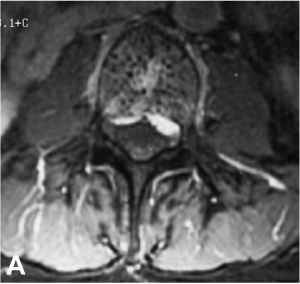
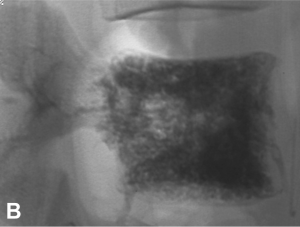
Exemple de traitement d’un angiome vertébral agressif hyper-algique par vertébroplastie. A. IRM montrant
l’angiome avec une extension épidurale. B. Résultat après vertébroplastie montrant un remplissage complet du
corps vertébral.
Ostéome ostéoïde :
Les ostéomes ostéoïdes sont de petites tumeurs bénignes généralement situées au niveau de l’arc postérieur de la vertèbre. Ils sont plus fréquents chez les sujets jeunes et se manifestent par des douleurs nocturnes.
Ces lésions sont accessibles à la radio-fréquence per-cutanée, qui permet de détruire la lésion par effet thermique, avec de bons résultats en terme antalgique.
Pour un avis sur le traitement d’une lésion osseuse primitive ou secondaire, vous pouvez nous contacter au 01 42 35 97
Discopathies dégénératives
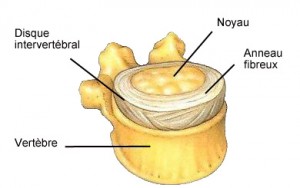
Le disque inter-vertébral est une sorte de coussinet assurant la congruence entre les corps vertébraux et amortissant les chocs auxquels la colonne vertébrale peut être soumise. Le disque est composé de 2 parties :
– le « nucleus pulposus » (noyau), central
– l’ « annulus fibrosus » (anneau fibreux), dans la périphérie du disque
Du fait de sollicitations mécaniques excessives, le disque peut perdre ses propriétés élastiques, conduisant à une réduction de hauteur, pouvant s’associer à une protrusion. Si celle-ci est postérieure, elle peut s’accompagner de douleurs par compression d’une ou plusieurs racines nerveuses cheminant à proximité.
Le traitement de ces discopathies hyper-algiques peut être médicamenteux (antalgiques, anti-inflammatoires), per-cutané (ozonothérapie ou infiltration), voire, rarement, chirurgical.
Les techniques de traitement per-cutané des discopathies sont principalement
– l’ozonothérapie (ou nucléolyse à l’ozone)
Cette technique consiste à injecter un gaz (l’ozone; O3) dans le disque afin d’entrainer une déshydratation progressive du disque. Ceci entraine une baisse de la pression intra-discale, réduisant la compression radiculaire.
L’intervention se réalise sous anesthésie locale. Une aiguille est positionnée, sous contrôle radiologique, dans la partie centrale du disque inter-vertébral. Puis, quelques mL d’ozone vont être injectés dans le disque. Une infiltration par corticoïdes de la racine nerveuse à proximité peut être réalisée à la fin du geste.
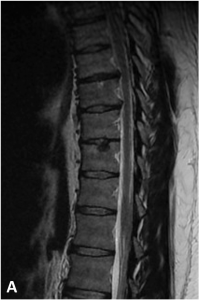
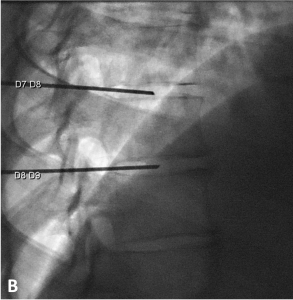
Exemple de discopathies thoraciques hyper-algiques traitées par ozonothérapie
– l’infiltration par corticoïdes
Cette technique se réalise sous anesthésie locale. Une aiguille est positionnée à proximité de la
racine nerveuse comprimée par la protrusion discale sous contrôle radiologique. Une injection
d’une faible quantité de produit de contraste permet de s’assurer du bon positionnement de
l’aiguille. Enfin, l’anti-inflammatoire (corticoïde) est injecté localement. Cette injection peut
reproduire les douleurs à type de sciatique ou de cruralgie. Plusieurs infiltrations peuvent être
nécessaire pour obtenir l’effet antalgique.
Pour un avis pour une éventuelle ozonothérapie ou infiltration, vous pouvez nous contacter au 01 42 35 97 ou au 01 42 16 35 94
Malformations vasculaires médullaires
Les malformations vasculaires médullaires sont des pathologies rares affectant la moelle épinière. Elles correspondent à une malformation des vaisseaux de la moelle ou de ses enveloppes. Ces malformations peuvent se manifester sur un mode hémorragique, réalisant un hématome intra-médullaire, ou peuvent être révélées par un déficit neurologique (para-parésie, paraplégie, troubles de la marche, troubles sensitifs, troubles sphinctériens, …) en rapport avec une gène au retour veineux médullaire. Parmi ces malformations on compte :
– les cavernomes médullaires
– les fistules médullaires
– les malformations artério-veineuses médullaires
1. Cavernomes médullaires :
Les cavernomes sont des malformations des capillaires. Plus fréquemment rencontrés à l’étage intra-crânien, ils peuvent, plus rarement, s’observer à l’étage médullaire (5% des cas). Ces lésions, lorsqu’elles sont typiques à l’IRM ne nécessitent pas de réaliser une angiographie. Leur traitement est parfois chirurgical.
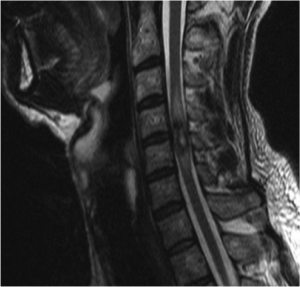
Exemple de cavernome médullaire cervical en IRM
2. Fistules médullaires :
Les fistules médullaires sont des communications anormales entre des artères vascularisant la moelle ou ses enveloppes et les veines péri-médullaires. Elles touchent plus souvent les sujets masculins âgés et se manifestent la plupart du temps sous la forme d’un oedème par engorgement veineux. Lorsqu’elles sont diagnostiquées, leur traitement doit être rapide car le potentiel de récupération neurologique dépend de la durée d’évolution des symptômes déficitaires.
Leur traitement peut être endovasculaire (occlusion de la communication anormale entre artère et veine par une colle biologique) ou chirurgicale (coagulation de la communication artère/veine).
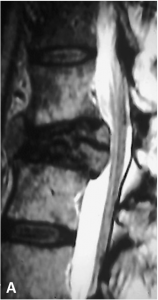
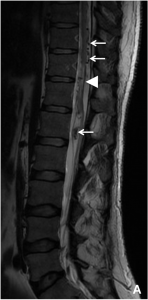
A. IRM médullaire (coupe sagittale pondérée en T2) chez un patient présentant une paraplégie depuis
plusieurs mois. Visualisation de vaisseaux serpigineux anormalement dilatés autour du cordon
médullaire (flèches blanches) et d’un oedème médullaire (hypersignal ; tête de flèche).
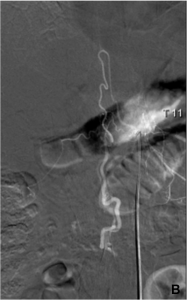
B. Angiographie médullaire confirmant le diagnostic de fistule médullaire du cône, avec opacification
anormalement précoce de veines péri-médullaires au temps artériel.
3. MAV médullaires :
Les MAV médullaires sont caractérisées par un peloton de vaisseaux malformatifs (appelé nidus) situé dans la moelle, alimenté par des artères vascularisant la moelle et se drainant dans les veines péri-médullaires. Elles peuvent se révéler par un hématome intra-médullaire, par des douleurs, par un déficit neurologique progressif des membres ou des troubles génito-sphinctériens.
Le traitement des MAV médullaires peut être endovasculaire par occlusion des vaisseaux du nidus avec une colle biologique, ou chirurgical par résection microchirurgicale du nidus.
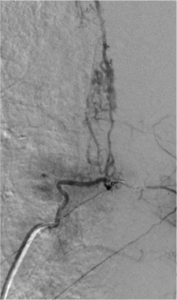
Angiographie médullaire montrant une MAV médullaire,
chez une patiente présentant des douleurs aux membres
inférieurs.
Pour un avis sur une malformation vasculaire médullaire, vous pouvez nous contacter au : 01 42 16 35 99 ou au 01 42 16 35 95
Pour une suspicion de MAV ou fistule médullaire, une angiographie médullaire devra être réalisée. Avant cet examen, le neuroradiologue vous recevra en consultation pour vous expliquer le déroulement de l’examen. Par le suite, votre dossier sera discuté en staff multi-disciplinaire. L’indication thérapeutique et la modalité la plus adaptée (chirurgie ou embolisation) seront discutées. Vous serez ensuite reconvoqué en consultation pour que vous soit exposée la proposition thérapeutique, ses bénéfices, risques et modalités pratiques de réalisation.
Malformations vasculaires superficielles
Les malformations vasculaires superficielles sont des pathologies rares. Elles peuvent être responsables de saignement ou d’un préjudice esthétique, surtout lorsqu’elles sont localisées au niveau de la face.
Parmi ces malformations, on compte principalement :
– l’angiome plan
– l’hémangiome
– les lymphangiomes kystiques
– les malformations veineuses pures
– les fistules artério-veineuses superficielles
– les malformations artério-veineuses superficielles
1. Angiome plan
L’angiome plan (appelé vulgairement « tache de vin ») est une malformation vasculaire non-agressive présente à la naissance. Il peut nécessiter un traitement du fait d’un préjudice esthétique. Celui-ci se fait au moyen d’un LASER.
2. Hémangiome
L’hémangiome est une lésion vasculaire bénigne affectant l’enfant. Elle représente 10 à 12% des tumeurs bénignes de l’enfant. Cette lésion apparait après la naissance, durant les premières semaines de vie. Son évolution est caractéristique en 3 phases :
– phase proliférative, qui est caractérisée par une augmentation rapide de taille de la tumeur jusqu’à 6 à 12 mois
– phase involutive : l’hémangiome cesse de croitre puis involue progressivement. Cette phase peut durer de 12 mois à 7 ans.
– phase cicatricielle. L’hémangiome laisse une cicatrice fibre-adipeuse, parfois associée à des télangiectasies en périphérie de la cicatrice.
Les options thérapeutiques des hémangiomes peuvent être : l’abstention thérapeutique, la corticothérapie, les bêta-bloquants, et parfois la chirurgie.
3. Lymphangiomes kystiques
Les lymphangiomes sont des malformations des vaisseaux lymphatiques. Ils peuvent être micro ou macro-kystiques. Ils peuvent occasionner une gène esthétique ou fonctionnelle. Leur traitement peut se faire par technique de radiologie interventionnelle (injection per-cutanée d’un agent sclérosant ou d’une chimio-thérapie) ou par chirurgie d’exérèse.
4. Malformations veineuses pures
Ce sont des lésions bénignes et non-aggressives. Elles sont souvent localisées au niveau des lèvres, des joues ou de la langue. Ce sont de véritables varices (veines incontinentes). Le traitement consiste en une injection locale (piqure dans la lésion) d’un agent sclérosant. Parfois, plusieurs séances sont nécessaires pour « assécher » la lésion.
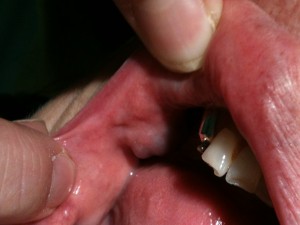
Exemple de malformation veineuse de la face
interne de la joue droite
5. Fistules artério-veineuses superficielles
Les fistules artério-veineuses superficielles sont des malformations vasculaires agressives à haut débit. Elles sont la plupart du temps d’origine traumatique. Elles consistent en une communication directe et anormale entre une artère et une veine sous-cutanées. Elles peuvent être à l’origine d’un préjudice esthétique. Ces fistules peuvent se traiter par voie endovasculaire, par injection de colle biologique.
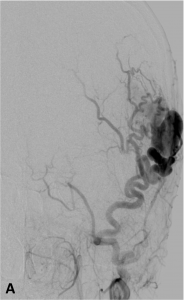
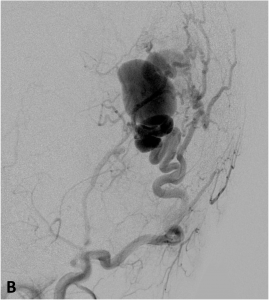
Exemple de fistule artérioveineuse sous-cutanée occipitale en angiographie
de face (A) et profil (B).
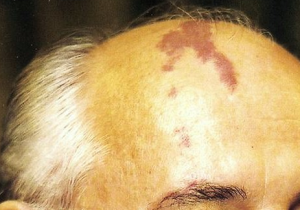
6. Malformations artério-veineuses (MAV) superficielles
Ces lésions sont des malformations vasculaires agressives à haut débit. Elles se présentent sous la forme de masses battantes pulsatiles sous-cutanées. Elles peuvent être responsables de saignements, voire d’une insuffisance cardiaque lorsqu’elles sont volumineuses chez le nourrisson. L’augmentation de taille de ces lésions s’observe principalement durant la puberté ou la grossesse, plaidant pour une influence hormonale sur la croissance de ces lésions.
Ces malformations vasculaires sont caractérisées par des apports artériels, un réseau de vaisseaux malformatifs appelé « nidus », et une ou plusieurs veines de drainage.
Comme pour les MAV cérébrales, le traitement endovasculaire consiste à occlure les vaisseaux malformatifs par un agent embolique liquide (colle biologique ou Onyx). Une chirurgie complémentaire peut parfois être nécessaire.
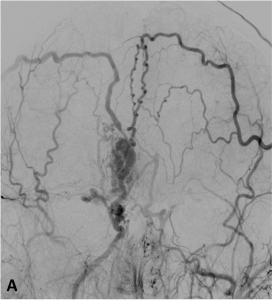
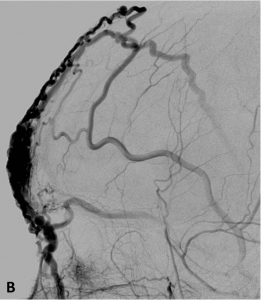
Exemple de MAV superficielle frontale en angiographie de face (A) et profil (B).
Ces pathologies doivent être prises en charge de façon multidisciplinaire par une équipe comprenant : des radiologues interventionnels, des chirurgiens plasticiens, des dermatologues et des dentistes (pour les lésions de la cavité buccale). A cet égard le service de NRI, en collaboration avec le service de chirurgie maxillo-faciale du Pr Goudot, organise une consultation multi-disciplinaire tous les 2 mois dans le service de chirurgie maxillo-faciale de la Pitié-Salpêtrière.
Pour prendre rendez-vous pour un avis sur une malformation vasculaire superficielle, merci de nous contacter à ce numéro : 01 42 16 13 01.